摘要: 本文探討了中藥新藥的人用經(jīng)驗(yàn)應(yīng)用思路和中藥新藥申報(bào)與創(chuàng)新問題。結(jié)合澳大利亞古方來源中 成藥品種情況��、澳大利亞登記類藥品管理��、日本漢方制劑品種情況����、日本非處方藥管理模式進(jìn)行匯總分 析���。應(yīng)用人用經(jīng)驗(yàn)的重點(diǎn)在于不同風(fēng)險(xiǎn)程度和不同表述方式所對(duì)應(yīng)的適應(yīng)證需提供不同等級(jí)的臨床研究 證據(jù)。不同風(fēng)險(xiǎn)中藥新藥適應(yīng)證可選擇不同的表述方式����,不同的表述方式可考慮按對(duì)應(yīng)體系的臨床評(píng)價(jià) 標(biāo)準(zhǔn)來進(jìn)行評(píng)估。需重視做好中藥新藥傳承與創(chuàng)新的政策平衡��,建議在給予具有人用經(jīng)驗(yàn)的中藥注冊(cè)申 請(qǐng)政策優(yōu)惠的同時(shí)��,考慮給經(jīng)實(shí)驗(yàn)優(yōu)化的中藥獲批上市后銷售上的利好�。
2019年發(fā)布的《關(guān)于促進(jìn)中醫(yī)藥 傳承創(chuàng)新發(fā)展的意見》強(qiáng)調(diào)"加快構(gòu)建中醫(yī)藥理論�����、 人用經(jīng)驗(yàn)和臨床試驗(yàn)相結(jié)合的中藥注冊(cè)審評(píng)證據(jù)體系����, 優(yōu)化基于古代經(jīng)典名方、名老中醫(yī)方�、醫(yī)療機(jī)構(gòu)制劑等具有人用經(jīng)驗(yàn)的中藥新藥審評(píng)技術(shù)要求,加快中藥 新藥審批”��。本文總結(jié)出應(yīng)用人用經(jīng)驗(yàn)的相關(guān)考慮, 對(duì)澳大利亞古方來源中成藥品種情況�����、澳大利亞登記 類藥品管理�����、日本漢方制劑品種情況��、日本非處方藥(OTC) 管理模式的研究心得進(jìn)行匯總分析���,并對(duì)中 藥注冊(cè)申請(qǐng)進(jìn)行拓展思考�,提出“適應(yīng)證分類管理模 式"供參考�,探討中藥非處方藥申報(bào)思路,并對(duì)臨床 評(píng)價(jià)難點(diǎn)—— 無特定適應(yīng)證的證候類中藥或民族藥進(jìn) 行思考����。
1 人用經(jīng)驗(yàn)應(yīng)用的相關(guān)思考
人用經(jīng)驗(yàn)如何應(yīng)用,國內(nèi)外尚無成熟的應(yīng)用模式���, 因此����,人用經(jīng)驗(yàn)的應(yīng)用是政策制訂的難點(diǎn)之一。目前�, 關(guān)于人用經(jīng)驗(yàn)應(yīng)用的相關(guān)文件正在起草制訂中。本文 就相關(guān)問題進(jìn)行了思考����,通過對(duì)澳大利亞登記類藥品 管理、日本非處方藥 (OTC) 管理模式的研究心得進(jìn)行 匯總分析���,總結(jié)出人用經(jīng)驗(yàn)應(yīng)用的適用范圍��、基本要 求�����、臨床研究證據(jù)要求以及相關(guān)申報(bào)建議,以供探討�����。
1.1 中藥新藥審評(píng)審批政策研究思路
中藥新藥審評(píng)審批政策的總體思路為借鑒境外中 藥/植物藥審評(píng)審批政策的有益經(jīng)驗(yàn)���,獲得注冊(cè)監(jiān)管����、 技術(shù)要求、品種信息����,綜合分析得到有針對(duì)性的建議。
1.1.1 研究范圍的考慮因素 確定境外中藥/植物藥審 評(píng)審批相關(guān)的政策研究點(diǎn)�,考慮的因素包括:①在境 外以藥品身份上市銷售;②藥用物質(zhì)來源于中藥/草 藥/植物等天然物質(zhì)�。以這兩個(gè)因素作為研究對(duì)象的選 擇依據(jù),考慮重點(diǎn)研究兩個(gè)國家植物藥的管理情況和 技術(shù)要求����,包括日本漢方制劑和澳大利亞登記藥品。
1.1.2 日本漢方制劑 日本漢方制劑有兩種管理模式:
一是適應(yīng)證分類管理2(對(duì)適應(yīng)證進(jìn)行分類���,規(guī)定每 類適應(yīng)證可用的生藥),二是品種目錄管理3(類似于 經(jīng)典名方100首)��。日本漢方制劑以品種目錄管理的模 式為主��,同名稱品種不同廠家產(chǎn)品之間的處方量�����、提 取物量�、適應(yīng)證表述��、日服提取物量、日服飲片量等 均存在差異��。
1.1.3 澳大利亞登記藥品/經(jīng)評(píng)估登記藥品 澳大利亞藥品管理局 (Therapeutic Goods Administration,TGA) 對(duì)臨床研究證據(jù)進(jìn)行等級(jí)劃分[含隨機(jī)對(duì)照試驗(yàn)�����、比 較研究(非對(duì)照)�����、觀察性研究(隊(duì)列研究�����、病例對(duì)照 研究)�����、文獻(xiàn)等],并按風(fēng)險(xiǎn)程度劃分出高風(fēng)險(xiǎn)����、中風(fēng)險(xiǎn)�、低風(fēng)險(xiǎn)適應(yīng)證l56, 不同風(fēng)險(xiǎn)程度的適應(yīng)證提供不 同等級(jí)的證據(jù)。澳大利亞獲批的中成藥��,同名稱品種不 同廠家產(chǎn)品之間也存在和漢方藥類似的差異。
① 澳大利亞登記藥品的管理模式:制訂“許可成 分清單” (含藥材�����、化學(xué)成分�����、酶類等),“許可適應(yīng) 證清單”8(均為低風(fēng)險(xiǎn)適應(yīng)證)�����。在兩個(gè)清單范圍內(nèi) 的藥品��,提供證據(jù)后即可上市����,不一定需要提供申請(qǐng) 人的研究數(shù)據(jù)。
② 澳大利亞經(jīng)評(píng)估登記藥品適應(yīng)證9:應(yīng)包含一 個(gè)中風(fēng)險(xiǎn)適應(yīng)證�,并要求提供高質(zhì)量的研究數(shù)據(jù),含 非臨床藥效學(xué)和臨床研究數(shù)據(jù)����。澳大利亞經(jīng)評(píng)估登記 藥品的仿制藥或新藥上市路徑,含有中藥可申報(bào)的路 徑��,可為同名同方藥,以及中藥非處方藥上市注冊(cè)的 可能情形之一—— 同名同方的已上市中藥非處方藥的 上市申報(bào)提供參考�。
1.2 人用經(jīng)驗(yàn)的適用范圍
古方加減方、臨床經(jīng)驗(yàn)方���、名老中醫(yī)方��、醫(yī)療機(jī)構(gòu) 中藥制劑這四種來源的中藥新藥均具有臨床使用經(jīng)驗(yàn)�。 其中醫(yī)療機(jī)構(gòu)中藥制劑在處方�、工藝、用法用量�����、適應(yīng) 證等方面比較明確和固定�����,并且相對(duì)于其他三種以個(gè) 別醫(yī)師為主用藥的情況��,醫(yī)療機(jī)構(gòu)中藥制劑的應(yīng)用范 圍較廣���,可在醫(yī)院內(nèi)使用,或醫(yī)院間調(diào)劑使用�。因此應(yīng) 用人用經(jīng)驗(yàn)進(jìn)行申報(bào)資料減免的政策�����,建議從醫(yī)療機(jī) 構(gòu)中藥制劑開展調(diào)研�,為應(yīng)用人用經(jīng)驗(yàn)提供參考�。
1.3 人用經(jīng)驗(yàn)的基本要求
在日服處方量、處方藥味及藥味用量比例�����、制備 工藝���、劑型��、用法用量����、適應(yīng)證等方面�,需提供充分 證據(jù)證明人用經(jīng)驗(yàn)與擬申報(bào)新藥的一致性。除湯劑可 制成顆粒劑外�����,其余劑型應(yīng)當(dāng)與既往臨床應(yīng)用一致����。
1.4 人用經(jīng)驗(yàn)的臨床研究證據(jù)要求
應(yīng)用人用經(jīng)驗(yàn)的重點(diǎn)在于不同風(fēng)險(xiǎn)程度和不同表 述方式所對(duì)應(yīng)的適應(yīng)證需提供不同等級(jí)的臨床研究證 據(jù)��。結(jié)合對(duì)澳大利亞經(jīng)評(píng)估登記類藥品的管理模式�����, 對(duì)應(yīng)用人用經(jīng)驗(yàn)需提供的臨床研究證據(jù)整理如下��,詳 見表1及表2�。

從高到低臨床研究證據(jù)來源的層次為:系統(tǒng)評(píng)價(jià)�����、 多中心隨機(jī)對(duì)照試驗(yàn)���、小型隨機(jī)對(duì)照試驗(yàn)�����、比較研究(非 對(duì)照)����、觀察性研究(隊(duì)列研究、病例對(duì)照研究)�����、非系 統(tǒng)的廣義評(píng)價(jià)(包括數(shù)據(jù)庫)����、《中國藥典》����、 SCI 文獻(xiàn)。
1.5 人用經(jīng)驗(yàn)的申報(bào)建議
定位于高風(fēng)險(xiǎn)適應(yīng)證的具人用經(jīng)驗(yàn)的中藥新藥建 議簡化申報(bào)�����,即申報(bào)資料建議免藥效學(xué)試驗(yàn)���,不免2 期臨床����;定位于中風(fēng)險(xiǎn)適應(yīng)證的具人用經(jīng)驗(yàn)的中藥新藥建議申報(bào)資料免藥效學(xué)試驗(yàn)��,視情況免2期臨床���; 定位于低風(fēng)險(xiǎn)適應(yīng)證的具人用經(jīng)驗(yàn)的中藥新藥可考慮 備案形式�����。

����、
2 關(guān)于中藥新藥申報(bào)的拓展思考
為了更好地鼓勵(lì)中藥的創(chuàng)新發(fā)展,可考慮新增中藥 非處方藥的申報(bào)方式���,并針對(duì)無特定適應(yīng)證的證候類中 藥或民族藥臨床評(píng)價(jià)的難點(diǎn)尋找改善措施�����,結(jié)合對(duì)澳大 利亞登記類藥品�、日本非處方藥的注冊(cè)管理模式的研究 情況�,提出以下建議。
2.1 不同風(fēng)險(xiǎn)中藥新藥的適應(yīng)證表述及臨床評(píng)價(jià)標(biāo)準(zhǔn) 建議
通過對(duì)澳大利亞治療用品管理局 (TGA) 官網(wǎng)提 供的澳大利亞治療用品注冊(cè)簿 (ARTG) 數(shù) 據(jù) 庫 [ 以 及我國的藥智數(shù)據(jù)庫 進(jìn)行檢索�,梳理澳大利亞古方 來源中成藥、日本漢方制劑的同名稱不同獲批產(chǎn)品的 藥品概要或說明書信息���,結(jié)果見表3�。
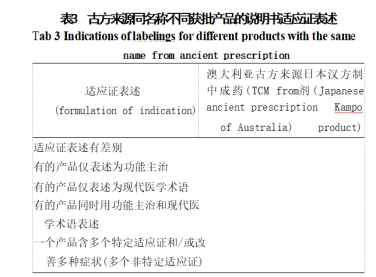
根據(jù)表3結(jié)果�����,對(duì)不同風(fēng)險(xiǎn)中藥新藥的適應(yīng)證表 述有以下建議:高風(fēng)險(xiǎn)適應(yīng)證僅以現(xiàn)代醫(yī)學(xué)術(shù)語表述, 或同時(shí)用功能主治和現(xiàn)代醫(yī)學(xué)術(shù)語表述�����;中��、低風(fēng)險(xiǎn) 適應(yīng)證表述可僅為功能主治���,或僅為現(xiàn)代醫(yī)學(xué)術(shù)語表 述,或同時(shí)用功能主治和現(xiàn)代醫(yī)學(xué)術(shù)語表述�����。由申請(qǐng) 人決定適合的表述方式��,并提供符合要求的人用經(jīng)驗(yàn) 證據(jù)����。根據(jù)申請(qǐng)人選擇的不同表述方式,按對(duì)應(yīng)體系 的臨床評(píng)價(jià)標(biāo)準(zhǔn)進(jìn)行評(píng)估�。
2.2 適應(yīng)證分類管理模式
可考慮劃分出若干中風(fēng)險(xiǎn)適應(yīng)證/功能主治范圍,并制訂每個(gè)適應(yīng)證/功能主治范圍內(nèi)許可使用的藥材清 單��。例如列出若干個(gè)適應(yīng)證范圍,每個(gè)適應(yīng)證范圍下細(xì) 分若干適應(yīng)證��,并為每個(gè)適應(yīng)證列出許可的藥材清單��, 可根據(jù)中醫(yī)理論或傳統(tǒng)醫(yī)藥理論進(jìn)行自由組方�����。適應(yīng) 證/功能主治的入選依據(jù)可參考我國古代名方的古代和 現(xiàn)代適應(yīng)證/功能主治�����,每個(gè)適應(yīng)證/功能主治范圍所 對(duì)應(yīng)藥材的入選依據(jù)可根據(jù)古代名方的古代和現(xiàn)代處 方藥味的使用情況進(jìn)行考慮��。在確定了適應(yīng)證/功能主 治范圍及其對(duì)應(yīng)的藥材清單的基礎(chǔ)上�,根據(jù)申報(bào)資料 的簡化程度,再考慮是否對(duì)處方藥味用量比例��、日服用 量����、制備工藝、劑型等進(jìn)行限定�。
2.3 中藥非處方藥申報(bào)建議
如考慮增加中藥非處方藥申報(bào),適用的情況包 括:①具有人用經(jīng)驗(yàn)����,定位于中�����、低風(fēng)險(xiǎn)適應(yīng)證的中 藥����。即定位于中風(fēng)險(xiǎn)適應(yīng)證的具人用經(jīng)驗(yàn)中藥�,建議 簡化申報(bào),即申報(bào)資料減免(免藥效學(xué)試驗(yàn)��,視情況 免2期臨床);定位于低風(fēng)險(xiǎn)適應(yīng)證的具人用經(jīng)驗(yàn)中藥���, 也可考慮備案形式。②適應(yīng)證分類管理范圍內(nèi)的����,定 位于中風(fēng)險(xiǎn)適應(yīng)證的中藥。
2.4 無特定適應(yīng)證的證候類中藥或民族藥申報(bào)建議
無特定適應(yīng)證的證候類中藥或民族藥在評(píng)估上存 在一定困難�����,為鼓勵(lì)該類新藥的研發(fā)��,可考慮的申報(bào) 思路為:①具有人用經(jīng)驗(yàn)中藥/民族藥的簡化申報(bào)或 考慮備案形式;②適應(yīng)證分類管理形式��。
3 中藥新藥傳承與創(chuàng)新的政策平衡
對(duì)于中藥新藥的傳承和創(chuàng)新�����,有兩種建議: 一種 是尊重臨床經(jīng)驗(yàn)���,保持與人用經(jīng)驗(yàn)的一致性���,不通過 實(shí)驗(yàn)研究追求優(yōu)質(zhì)處方、優(yōu)秀制法�、好的藥效,享受 減免藥效或臨床試驗(yàn)的政策利好���;另一種是遵循中 醫(yī)藥發(fā)展規(guī)律�����,將臨床經(jīng)驗(yàn)與藥學(xué)實(shí)驗(yàn)研究結(jié)合����,進(jìn) 行中藥新藥的研發(fā)�����、預(yù)測、評(píng)價(jià)�、擇優(yōu)?����?煽紤]的研 究方法舉例12-16:以藥效活性成分作為質(zhì)量控制指標(biāo) (Q-marker), 建立標(biāo)準(zhǔn)制劑控制模式�����,采用定量指紋 圖譜技術(shù)進(jìn)行研發(fā)�。具體措施包括:①采用處方均勻 設(shè)計(jì)法(要求用藥總量不變),以動(dòng)物的藥效實(shí)驗(yàn)結(jié)果 為參考,采用偏相關(guān)回歸分析法���,找到每個(gè)藥味與考 察的藥效指標(biāo)的相關(guān)系數(shù)大小����;②依據(jù)各藥味的藥效 作用指標(biāo)大小重新設(shè)計(jì)處方量,在第二次處方的藥效 實(shí)驗(yàn)結(jié)果基礎(chǔ)上篩選出好的藥效����、好的工藝�����,優(yōu)化處 方�����,在保持總藥效作用不變情況下盡可能降低日服用 量�����;③通過總結(jié)和研究譜效關(guān)系���,創(chuàng)建中藥標(biāo)準(zhǔn)制劑 的控制模式,實(shí)現(xiàn)藥效物質(zhì)量值傳遞的系統(tǒng)化控制����。
對(duì)于第1種尊重臨床經(jīng)驗(yàn)的情況,技術(shù)要求及申 報(bào)資料要求如放得過寬��,可能不利于中藥創(chuàng)新發(fā)展��。 第二種結(jié)合實(shí)驗(yàn)研究的研發(fā)方式��,可能采用更多的新 工藝���、新技術(shù)創(chuàng)新中藥����,對(duì)于中藥科研成果的轉(zhuǎn)化、 中藥品質(zhì)的提升�����、中藥價(jià)值的提高��、中藥產(chǎn)業(yè)的健康 發(fā)展有積極意義。中藥新藥的相關(guān)政策制訂,需在給 予尊重臨床經(jīng)驗(yàn)的中藥注冊(cè)申請(qǐng)政策優(yōu)惠的同時(shí)��,考 慮給經(jīng)實(shí)驗(yàn)優(yōu)化的中藥獲批上市后銷售上的利好,例如��,如果經(jīng)實(shí)驗(yàn)優(yōu)化的中藥新藥是在現(xiàn)代醫(yī)藥理論指 導(dǎo)下使用�����,其適應(yīng)證用現(xiàn)代醫(yī)學(xué)術(shù)語表述�����,則屬于天 然藥物新藥��,又可稱為“基于中藥提取的天然藥物”��。 從理論上理解����,天然藥物新藥在開具處方上不應(yīng)受限 于中醫(yī)醫(yī)師。
4 結(jié)語
守正創(chuàng)新����,不是守著傳統(tǒng)文化不變,而是重在文 化更新�����;不是以傳統(tǒng)經(jīng)驗(yàn)替代現(xiàn)代知識(shí)�����,而是以傳統(tǒng) 經(jīng)驗(yàn)輔以現(xiàn)代技術(shù)知識(shí)���,根據(jù)現(xiàn)代需要�����,用科學(xué)方法��, 學(xué)習(xí)和實(shí)踐古人的有益教誨�,這是當(dāng)前做好中藥守正 創(chuàng)新不可推卸的歷史責(zé)任。中藥事業(yè)的發(fā)展沒有現(xiàn)成 模式可以參考�����,中藥與西藥互為補(bǔ)充���,只有采用多元 化的思維方式�,構(gòu)建多層次���、多形式的中藥發(fā)展理念����, 才能開創(chuàng)中藥發(fā)展新局面�����。
